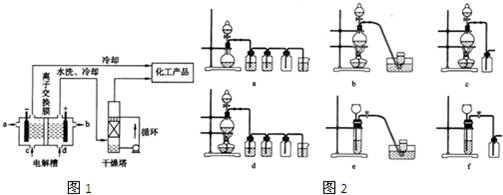
工业上电解饱和食盐水能制取多种化工原料,其中部分原料可用于制备多晶硅.下图1是离子交换膜法(允许钠离子通过,不允许氢氧根与氯离子通过)电解饱和食盐水,电解槽阳极产生的气体是______,NaOH溶液的出口为______(填字母),精制饱和食盐水的进口为______(填字母),干燥塔中应使用的液体是______.
(1)多晶硅主要采用SiHC13还原工艺生产,其副产物SiC14的综合利用受到广泛关注.SiC14可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiC14、H2、O2反应,产物有两种,化学方程式为______.SiC14可转化为SiC13而循环使用.一定条件下,在20L恒容密闭容器中反应3SiC14(g)+2H2(g)+Si(s)═4SiHC13(g)达平衡后,H2与SiHC13物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗NaC1的质量为______kg.
(2)如图2,实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4⇌ZnSO4+H2↑,MnO2+4HC1(浓)
MnC12+C12↑+2H2O△ . .
据此,从下列所给仪器装置中选择制备并收集H2的装置______(填代号)和制备并收集干燥、纯净C12的装置______(填代号).
可选用制备气体的装置:
(3)采用无膜电解槽电解饱和食盐水,可制取氯酸钠,同时生成氢气.现制得氯酸钠213.0kg,则生成氢气______m3(标准状况).(忽略可能存在的其他反应)
电解饱和食盐时阳极阴离子Cl-、OH-放电,Cl-的放电能力强于OH-,
阳极:2Cl--2e-═Cl2↑,
阴极:2H++2e-═H2↑;
总反应为:2NaCl+2H2O
Cl2↑+H2↑+2NaOH, 电解 .
阴极:氢离子放电,产生氢气.致使氢氧根离子浓度增大,钠离子和氢氧根离子的增大都发生在阴极室,所以a出口导出的液体是氢氧化钠溶液;
阳极:氯离子放电,产生氯气,致使钠离子浓度升高,通过阳离子交换膜到达阴极室.所以d入口应加入精制饱和食盐水;
要干燥Cl2需要用酸性干燥剂浓硫酸或P2O5等,中性干燥剂无水CaCl2.
故答案为:氯气;a;d;浓硫酸;
(1)①SiCl4与H2和O2反应,产物有两种,光导纤维的主要成分是SiO2,H、Cl元素必在另一产物中,H、Cl元素结合成HCl,然后配平即可,发生的化学方程式为:SiCl4+2H2+O2
SiO2+4HCl; 高温 .
②由3SiCl4(g)+2H2(g)+Si(s)⇌4SiHCl3(g)
起始量(mol) n 0
变化量(mol) 2x x 4x
平衡量(mol) n-2x 4x
4x=0.020mol/L×20L=0.4mol,x=0.1mol,
n-2x=0.140mol/L×20L=2.8mol,n=3.0mol,
由2NaCl+2H2O
Cl2↑+H2↑+2NaOH, 电解 .
2mol 1mol
=(2×58.5)g 1mol
,m(NaCl)=350g=0.35kgm(NaCl) 3mol
故答案为:SiCl4+2H2+O2
SiO2+4HCl;0.35; 高温 .
(2)实验室用锌和稀硫酸制取氢气,该反应是固液混合态且不需要加热,所以不需要酒精灯,氢气不易溶于水且密度小于空气密度,所以可以采用向下排空气法或排水法收集,故选e;
实验室制取氯气是固液混合态且需要加热,所以需要酒精灯,氯气能溶于水且密度大于空气,所以采用向上排空气法收集,故选d;
(3)由NaCl转化为NaClO3,失去电子数为6,H2O转化为H2,得到的电子数为2,
设产生的H2体积为Vm3,
由得失电子守恒得:6×
mol=2×213×103 116.5
mol,V=134.4m3,故答案为:134.4.103V 22.4
