问题
问答题
8.4g单质A能从足量的盐酸中置换出3.36L(标准状况下)的H2,同时生成ACl2;另一种元素B的最高价氧化物的化学式为BO3.在B的氢化物中,B的质量分数为94.1%.
(1)计算A、B两种元素的相对原子质量,写出相应的元素符号.______
(2)写出A、B反应的化学方程式,用双线桥标出电子转移情况.______.
答案
(1)设A、B的相对原子质量分别为MA、MB,则有:
A+2HCl=ACl2+H2↑
MAg 22.4L
8.4g3.36L
所以MAg:8.4g=22.4L:3.36L,解得MA=56,故A为Fe,
据题意可知,B的氢化物的化学式为H2B,故有2:MB=(1-94.1%):94.1%,解得MB≈32,故B为S,
故答案为:56,Fe;32,S;
(2)Fe与S发生反应Fe+S
FeS,转移电子数目为2,用双线桥标出电子转移为:△ . 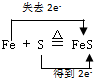 ,
,
故答案为: .
.
