问题
问答题
一定量的铁与稀盐酸反应,生成了4.48L(STP)氢气.
(1)用单线桥表示出该反应电子转移的方向.
(2)分别计算发生反应的氯化氢和铁的物质的量.
(3)若所用盐酸的浓度为0.5mol•L-1,则计算需要盐酸的体积:______.
答案
(1)发生反应:Fe+2HCl=FeCl2+H2↑,由元素的化合价变化可知转移的电子总数为2,用单线桥表示电子转移为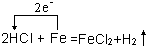 ,
,
答:单线桥表示Fe与盐酸反应电子转移的方向为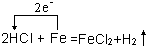 ;
;
(2)4.48L氢气的物质的量=
=0.2mol,则:4.48L 22.4L/mol
Fe+2HCl=FeCl2+H2↑
1 2 1
n(Fe) n(HCl)0.2mol
所以,n(Fe)=
=0.2mol,0.2mol×1 1
n(HCl)=
=0.4mol0.2mol×2 1
答:发生反应的氯化氢为0.4mol、铁的物质的量为0.2mol;
(3)所用浓度为0.5mol•L-1盐酸的体积=
=0.8L,故答案为:0.8L.0.4mol 0.5mol/L
