用31.6gKMnO4恰好氧化密度为1.19g/cm3,溶质质量分数为36.5%的盐酸.反应方程式如下:
2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O
(1)标出以上反应电子转移的方向和数目.
(2)有多少摩尔HCl被氧化?______
(3)产生的Cl2在标准状况下的体积为多少?______
(4)求消耗该盐酸溶液的体积?______.
(1)反应中高锰酸钾为氧化剂,HCl为还原剂,Mn元素的化合价+7→+2,和Cl元素的化合价-1→0,反应中氧化剂和还原剂得失电子数目相等,反应电子转移的方向和数目为: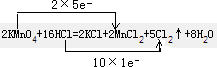 ,
,
答:反应电子转移的方向和数目为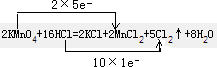 ;
;
(2)31.6gKMnO4的物质的量为
=0.2mol,则:31.6g 158g/mol
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
2165
0.2mol n(HCl) n(Cl2)
所以,n(Cl2)=
=0.5mol,被氧化的HCl生成氯气,故被氧化的HCl的物质的量为0.5mol×2=1mol,故答案为:1mol;0.2mol×5 2
(3)V(Cl2)=0.5mol×22.4L/mol=11.2L,故答案为:11.2L;
(4)消耗的n(HCl)=
=1.6mol,0.2mol×16 2
该盐酸的物质的量浓度为
mol/L=11.9mol/L,1000×1.19×36.5% 36.5
故消耗盐酸的体积为
=0.134L,1.6mol 11.9mol/L
故答案为:0.134L.
