问题
问答题
实验室里通常用MnO2与浓盐酸在加热的条件下反应制取氯气,为进行有关氯气的性质实验,需要4瓶容积为100ml的氯气(标准状况).
(1)写出实验室制取氯气的化学反应方程式并标出电子转移的方向及数目.
(2)制取4瓶氯气,理论上需要MnO2固体的质量是多少?(浓盐酸过量,并可以补充)
(3)实际称量的MnO2固体的质量必需多于理论量,主要原因是什么?
答案
(1)反应方程式为MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,转移电子数为2e-,用双线桥表示电子转移数目与方向为:△ . 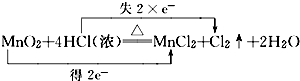 ,
,
答:实验室制取氯气的化学反应方程式并标出电子转移的方向及数目为: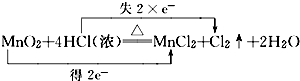 .
.
(2)氯气的物质的量=
=0.4L 22.4L/mol
mol,根据方程式MnO2+4HCl(浓)1 56
MnCl2+Cl2↑+2H2O可知,需要二氧化锰的物质的量=△ .
mol,故需要二氧化锰的质量=1 56
mol×87g/mol=1.55g,1 56
答:需要二氧化锰的质量为1.55g.
(3)所产生的氯气不可能完全被收集、利用,故实际称量的MnO2固体的质量必需多于理论量,
答:实际称量的MnO2固体的质量必需多于理论量的主要原因是:所产生的氯气不可能完全被收集、利用.
