问题
选择题
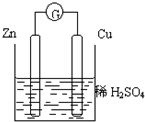
关于如图所示的装置的叙述,正确的是( )
A.电流从锌片经导线流向铜片
B.一段时间后,电解质溶液中的硫酸根浓度减小
C.铜是正极,铜片上有气泡产生,锌片质量减少
D.一段时间后,电解质溶液的酸碱性保持不变
答案
A、该原电池中锌作负极,铜作正极,所以电子从负极锌沿导线流向正极铜,电流流向与电子流向相反,即电流从铜片经导线流向锌片,故A错误.
B、负极上锌失电子生成锌离子进入溶液,正极上氢离子得电子生成氢气,硫酸根离子没有析出所以浓度不变,故B错误.
C、负极上锌失电子生成锌离子进入溶液,所以锌质量减少;正极铜上氢离子得电子生成氢气,故C正确.
D、正极上氢离子得电子生成氢气,所以导致溶液中氢离子浓度降低,溶液的PH值增大,故D错误.
故选C.
