问题
选择题
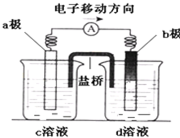
若将反应:Zn+H2SO4=ZnSO4+H2↑设计成原电池(装置如图),则下列说法正确的是( )
A.d溶液是稀硫酸
B.c溶液颜色变蓝
C.b极发生氧化反应
D.a极是铜棒
答案
Zn+H2SO4=ZnSO4+H2↑设计成原电池,根据化合价变化知,负极是锌,负极上锌失电子发生氧化反应,正极上氢离子得电子发生还原反应生成氢气,电子从负极沿大小流向正极,根据图片中电子的流向知,a是原电池负极,b是原电池正极,该原电池中含有盐桥,则c溶液是硫酸锌溶液,d溶液是稀硫酸.
A.通过以上分析知,d是稀硫酸,故A正确;
B.c溶液是硫酸锌溶液,为无色溶液,故B错误;
C.b是正极,正极上发生还原反应,故C错误;
D.a是锌棒,故D错误;
故选A.
