问题
选择题
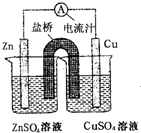
如图为一原电池的结构示意思,下列说法中,不正确的是( )
A.原电池工作时的总反应为Zn+Cu2+=Zn2++Cu,该反应一定为放热反应
B.原电池工作时,Zn电极流出电子,发生氧化反应
C.原电池工作时,铜电极上发生氧化反应,CuSO4溶液蓝色变深
D.如果将Cu电极改为Fe电极,Zn电极依然作负极
答案
A、该原电池放电时,较活泼的金属锌作负极,负极上锌失电子发生氧化反应,较不活泼的金属铜作正极,正极上铜离子得电子发生还原反应,所以电池反应式为:Zn+Cu2+=Zn2++Cu,且构成原电池的条件之一是:化学反应必须是能自发进行的氧化还原且放热的反应,该反应是一个放热反应,故A正确.
B、原电池工作时,较活泼的金属锌作负极,锌失去电子发生氧化反应,所以电子从锌极流出,故B正确.
C、原电池工作时,较不活泼的金属铜作正极,正极上铜离子得电子发生还原反应,所以正极上有铜单质析出导致
CuSO4溶液蓝色变浅,故C错误.
D、如果将Cu电极改为Fe电极,锌的金属性大于铁,所以Zn电极依然作负极,故D正确.
故选C.
