有一种复盐A,其分子式组成可以表示为:FeSO4·m(NH4)2SO4·nH2O,取9.604g盐加入足量的烧碱,加热,产生的气体用100mL,10.5mol·L-1硫酸吸收,过量的硫酸再用25.5mL2mol·L-1的烧碱溶液恰当充分中和,9.604gA加入浓烧碱溶液时产生白色沉淀,在空气中逐渐变为红褐色,滤出后在蒸发皿中加强热,得1.96g红色粉末,求A的分子式。
FeSO4·(NH4)2SO4·6H2O
①求组成复盐的基本粒子FeSO4,(NH4)2SO4,H2O的物质的量:
a.(NH4)2SO4的物质的量:
2NaOH+H2SO4====Na2SO4+2H2O
所以与NH3反应的硫酸为:
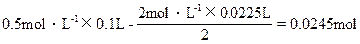
NH4++OH-====NH3↑+H2O
2NH3+H2SO4====(NH4)2SO4
所以推出下列关系:2NH+4 ~ H2SO4
2mol 1mol
x="0.049mol " 0.0245mol
所以9.604g复盐中(NH4)2SO4的物质的量为:
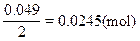
b.求FeSO4的物质的量:
因为FeSO4+2NaOH====Fe(OH)2↓+Na2SO4
4Fe(OH)2+O2+2H2O====4Fe(OH)3
2Fe(OH)3 Fe2O3+3H2O
Fe2O3+3H2O
所以推出下列关系式:
2FeSO4 ~ Fe2O3
2mol 1mol
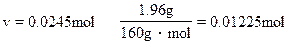
即9.604g复盐中含FeSO4:0.0245mol。
c.求水的物质的量:
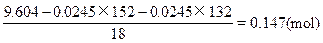
②基本粒子最简物质的量整数比:
FeSO4∶(NH4)2SO4∶H2O=0.0245∶0.0245∶0.147=1∶1∶6
③实际物质的量比等于分子系数比,A复盐的分子式为:
FeSO4·(NH4)2SO4·6H2O
