铁及其化合物在日常生活、生产中应用广泛.研究铁及其化合物的应用意义重大.
I.水体的净化和污水的处理与铁及其化合物密切相关.
(1)自来水厂常用高铁酸钠(Na2FeO4)改善水质.简述高铁酸钠用于杀菌消毒同时又起到净水作用的原理______.
(2)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
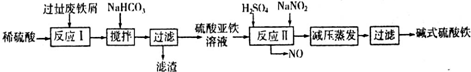
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
①写出反应I中主要发生的氧化还原反应的离子方程式______.
②加入少量NaHCO3的目的是调节溶液pH,应控制pH的范围为______.
③在实际生产中,反应II常同时通入O2以减少NaNO2的用量,若通入5.6L O2(标准状况),则相当于节约NaNO2的质量为______g.
④碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子.该水解反应的离子方程式为______.
II铁的化合物也是制备高能锂电池的重要原料.已知磷酸亚铁锂电池总反应为:FePO4+Li
LiFePO4,电池中的固体电解质可传导Li+.试写出该电池充电时的阳极反应式______. △ .
Ⅰ.(1)高铁酸钠具有强氧化性,可用于杀菌消毒,还原生成Fe3+,Fe3+发生水解生成氢氧化铁胶体吸附水中的杂质,可用来除去水中的悬浮物,达到净水的目的,
故答案为:FeO42-有强的氧化性,能杀菌消毒,本身被还原为Fe3+,Fe3+发生水解生成氢氧化铁胶体吸附水中的杂质,达到净水的目的;
(2)①Fe为活泼金属,可与酸反应,反应的离子方程式为Fe+2H+═Fe2++H2↑,故答案为:Fe+2H+═Fe2++H2↑;
②制备硫酸亚铁,应与硫酸铝分离,应调节溶液pH生成Al(OH)3,要避免生成应Fe(OH)2沉淀,控制pH在4.4~7.5之间,
故答案为:4.4~7.5;
③n(O2)=
=0.25mol,则得到电子0.25mol×4=1mol,1molNaNO2被还原生成NO,化合价由+3价降低到+2价,得到1mol电子,则m(NaNO2)=1mol×69g/mol=69g,5.6L 22.4L/mol
故答案为:69;
④[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子,根据电荷守恒和质量守恒可写出反应的离子方程式为
2[Fe(OH)]2++2H2O

[Fe2(OH)4]2++2H+,
故答案为:2[Fe(OH)]2++2H2O

[Fe2(OH)4]2++2H+;
Ⅱ.阳极发生氧化反应,由总反应式FePO4+Li
LiFePO4可知,LiFePO4被氧化生成FePO4,反应的电极方程式为LiFePO4-e-═FePO4+Li+, △ .
故答案为:LiFePO4-e-═FePO4+Li+.
