问题
计算题
(8分)现用Zn与实验室中的盐酸反应制取4.48L H2(标准状况)。
(1)如果选用所贴标签为2.0mol·L-1的盐酸,至少需该盐酸多少毫升?
(2)如果选用所贴标签为7%(密度为1.043g·mL-1)的盐酸,至少需该盐酸多少毫升?
答案
(1)200mL (2)200mL
(1)
Zn + 2HCl =" " ZnCl2 + H2↑
2 mol 22.4L
n(HCl) 4.48L
n(HCl)= 4.48L÷22.4L×2 mol ="0.4" mol
V(HCl)= n(HCl)÷c(HCl)=" 0.4" mol÷2.0mol·L-1 =" 0.2L" = 200mL
(2)
Zn + 2HCl =" " ZnCl2 + H2↑
73g 22.4L
m(HCl) 4.48L
m(HCl)= 4.48L÷22.4L×73 g ="14.6" g
V(HCl)= m(HCl)÷W(HCl)÷ρ(HCl)=" 14.6" g÷7% ÷1.043g·mL-1 = 200mL
提示:(1)、(2)小题结果相同,请体会哪种浓度表示方法更方便?

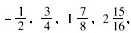 ()
()