下列四种装置中,溶液的体积均为250mL,开始时电解质溶液的浓度均为0.10mol/L,工作一段时间后,测得导线上均通过0.02mol电子,若不考虑溶液体积的变化,则下列叙述正确的是( )
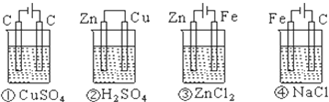
A.工作一段时间后溶质的物质的量浓度①=②=③=④
B.工作一段时间后溶液的pH:④>③=①>②
C.产生气体的总体积:④>②>①>③
D.电极上析出的固体的质量:①>②>③>④
①为电解池,反应方程式为2CuSO4+2H2O
2Cu+O2↑+2H2SO4,每生成1mol O2,转移4mol电子,消耗2mol CuSO4,反应后,溶液pH降低. 电解 .
②为原电池,锌为负极,Zn-2e-=Zn2+,铜为正极2H++2e-=H2↑每生成1mol H2,转移,2mol电子,消耗1mol H2SO4,溶液pH升高.
③为电镀池,阳极反应是阳极金属失去电子而被氧化成阳离子;阳极Zn-2e-=Zn2+,阴极反应是溶液中的Zn2+得电子的还原反应,Zn2++2e-=Zn溶液中Zn2+浓度不变.
④为电解池,反应方程式为2NaCl+2H2O
H2↑+2NaOH+Cl2↑每生成1mol H2,转移2mol电子,消耗NaCl为2 mol,反应后,溶液pH升高. 电解 .
A.当溶液的体积均为250mL,开始时电解质溶液的浓度均为0.10mol/L,工作一段时间后,测得导线上均通过0.02mol电子,①消耗CuSO4为0.01 mol,②消耗0.01mol H2SO4,③ZnSO4溶液的浓度不变.④消耗NaCl为0.02 mol.故A错误;
B.④反应后,溶液pH升高.消耗NaCl为0.02 mol.生成0.02 mol NaOH,溶液呈碱性.③Zn2+浓度不变,
Zn2+水解,溶液略呈酸性.碱性④>③;
②溶液pH升高,但仍呈酸性,剩余0.025mol-0.01 mol=0.015 mol H2SO4.①反应后,溶液pH降低,呈酸性,生成0.01 mol H2SO4,酸性:②>①;
①的溶液是酸性溶液,③是盐溶液,酸性较弱,所以pH值③>①;
通过以上分析知,工作一段时间后溶液的pH:④>③>①>②,故B错误.
C.导线上均通过0.02mol电子.①产生0.005mol O2.②产生0.01mol H2.③产生气体为0.④产生0.01mol H2和0.01mol Cl2.产生气体的总体积:④>②>①>③故C正确.
D.导线上均通过0.02mol电子.①电极上析出0.01mol Cu固体质量为0.64克,②电极上析出的固体的质量为0.③铁电极上析出0.01mol Zn固体的质量为0.65克.④电极上析出的固体的质量为0.电极上析出的固体的质量:③>①>②=④.故D错误.
故选C.
