对下图中两极加以必要的连接并填空:
(1)在A图中,使铜片上冒出大量H2气泡.请加以必要连接.
写出负极上的电极反应式:______.
(2)在B图中,使b极析出Cl2,加以必要的连接后,该装置叫______.
总反应方程式:______.
经过一段时间后,溶液的pH值______(填升高、降低、不变)
(3)若将A、B串联(a接Cu,b接Zn),则a极析出的物质是______.当Zn片质量减少32.5g时,b极析出物质在标准状况下的体积为______ L.
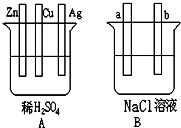
在A图中,锌与稀硫酸反应,而铜和银与稀硫酸不反应,所以只能选锌作负极,根据题意知,铜作正极;
在B图中,使b极析出Cl2,溶液好氯离子失电子,所以该装置只能是电解池,b极上反应氧化反应,所以b极连接电源正极,a极两极电源负极.
故两装置图为:
(1)通过上面分析知,锌作负极,锌失电子变成离子进入溶液,所以电极反应式为Zn-2e=Zn2+
故答案为:Zn-2e=Zn2+
(2)通过上面分析知,该装置为电解池,溶液中氯离子的放电能力大于氢氧根离子,所以在b电极上得氯气;氢离子的放电能力大于钠离子,所以在a极上得氢气,同时溶液中生成氢氧化钠,
所以电池反应式为2NaCl+2H2O
H2↑+2NaOH+Cl2↑. 电解 .
随着反应的进行,溶液中氢氧根离子的浓度越来越大,氢离子的浓度越来越小,所以溶液的PH值升高.
故答案为:电解池;2NaCl+2H2O
H2↑+2NaOH+Cl2↑;升高. 电解 .
(3)若将A、B串联,A是原电池,B是电解池,原电池中锌作负极,铜作正极;串联后,a接Cu,所以a是阳极,
b接Zn,b是阴极.a极上氯离子失电子生成氯气,b极上氢离子得电子生成氢气.根据串联时,各电极上得失电子数相等知,锌失去的电子等于生成氢气时得到的电子,
即n(Zn)×2=n(H2)×2.
×2=32.5g 6565g/mol
×2VL 22.4L/mol
所以v=11.2
故答案为:Cl2; 11.2.
