如图:以一铜锌合金为阳极,一纯铜为阴极(起始时两电极质量相等),进行电解,电解液为硫酸铜溶液,当外电路有1.806×1023个电子转移时,阴极比阳极重19.25g,求铜锌合金中铜的质量分数.
(已知:电极反应式为 阳极:Zn-2e-=Zn2+、Cu-2e-=Cu2+阴极:Cu2++2e-=Cu )
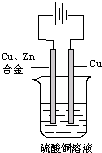
电解时,设阳极上消耗锌的物质的量为xmol,消耗铜ymol,
转移的电子的物质的量为
=0.3mol1.806×1023个 6.02×1023个/mol
Zn-2e-=Zn2+
1 2
x 2x
Cu-2e-=Cu2+
1 2
y 2y
所以阳极失电子的物质的量为2x+2y=0.3mol①,
Cu2++2e-=Cu
2mol 1mol
0.3mol 0.15mol
所以生成的铜的质量为 0.15mol×64g/mol=9.6g,
两电极上的质量差为:阴极上增加的质量加上阳极上减少的质量=9.6g+65x+64y=19.25g②
所以①②②组成方程组为2x+2y=0.3mol 9.6g+65x+64y=19.25g
解得x=0.05 y=0.1
铜锌合金中铜的质量分数为
×100%=66.3%.64g/mol×0.1mol 64g/mol×0.1mol+65g/mol×0.05mol
答:铜锌合金中铜的质量分数为66.3%.