问题
多选题
下列叙述正确的是( )
A.电镀时,通常把待镀的金属制品作阳极
B.图中电子由Zn极流向Cu,盐桥中的Cl-移向CuSO4溶液
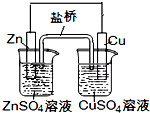
C.氢氧燃料电池(酸性电解质)中O2通入正极,电极反应为O2+4H++4e-=2H2O
D.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
答案
A.电镀时,通常把待镀的金属制品作阴极,故A错误;
B.该原电池中,锌作负极,铜作正极,电子从锌沿导线流向铜,盐桥中的Cl-移向ZnSO4溶液,故B错误;
C.氢氧燃料电池中,正极上氧气得电子发生还原反应,因为电解质溶液呈酸性,所以正极上氧气得电子和氢离子反应生成水,其电极反应式为:O2+4H++4e-=2H2O,故C正确;
D.锌、铁和海水构成原电池,锌比铁易失去电子作负极,铁作正极,正极上得电子发生还原反应,从而保护铁被腐蚀,该方法属于牺牲阳极的阴极保护法,故D正确;
故选CD.
