问题
选择题
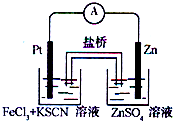
实验发现,在FeCl3酸性溶液中加入少量锌粉后,Fe3+立即被还原成Fe2+.某化学兴趣小组根据该实验事实设计了如图所示的原电池装置.下列有关说法中正确的是( )
A.该原电池的正极反应是:Zn-2e-=Zn2+
B.Pt电极表面生成大量气泡
C.生成的Fe2+通过盐桥可以和锌直接反应生成Fe
D.左烧杯中溶液的红色逐渐褪去
答案
A.该原电池的正极反应是Fe3++e-═Fe2+,负极反应为Zn-2e-=Zn2+,故A错误;
B.该原电池反应为Zn+2FeCl3═2FeCl2+ZeCl2,该反应不生成气体,故B错误;
C.原电池中阳离子移动到正极,则生成的Fe2+在左边的烧杯中,故C错误;
D.左边烧杯中发生Fe3++e-═Fe2+,则左烧杯中溶液的红色逐渐褪去,故D正确;
故选D.
