问题
填空题
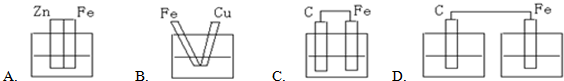
(1)下列能构成原电池的是______(A、B、C、D中的电解质溶液均为稀硫酸)(填编号)
(2)A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.
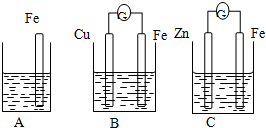
①B中Cu极电极反应式为______;
②C中被溶解的金属是______,总化学反应方程式为______;
③A.B、C中铁被溶解的速率,由大到小的顺序是______.
答案
(1)A、B、C符合原电池的构成条件,D没有构成闭合回路,所以不能构成原电池.
故选ABC;
(2)①该电池中,铁失电子生成二价铁离子进入溶液,铁片逐渐溶解,所以铁作负极,铜作正极,正极上氢离子得电子生成氢气,所以电极反应式为2H++2e-=H2↑.
故答案为:2H++2e-=H2↑;
②该电池中锌失电子生成锌离子进入溶液,所以锌逐渐溶解,锌作负极,铁作正极,
电池反应式为:Zn+H2SO4=ZnSO4+H2↑,故答案为:Zn;Zn+H2SO4=ZnSO4+H2↑;
③通过以上分析知,B装置加快了铁片的溶解,C装置减慢了铁片的溶解,所以反应速率由大到小的顺序是B>A>C.
故答案为:B>A>C.
