问题
计算题
将6.5gZn加入到200mL的稀盐酸溶液中,恰好完全反应。
(1)写出该反应的化学方程式,并标出电子转移方向和数目。
(2)试求生成气体在标准状况下的体积和稀盐酸的物质的量浓度。
(3)计算反应中转移的电子数目。
答案
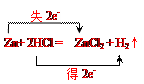 (1)
(1)
(2)2.24L 1mol/L (3)1.204×1022
(2)Zn+ 2HCl =" " ZnCl2 + H2↑
1mol 2mol 22.4L
0.1mol x V
据此可以解答生成H2的体积V=2.24L,反应中消耗的盐酸的物质的量x=0.2mol,则盐酸的物质的量浓度为0.2mol/0.2L
=1mol/L。
(3)根据反应可知,1molZn参与反应转移2mol电子,根据正比关系可知,0.1molZn参与反应转移电子为0.2mol,即反应中转移电子数为0.2×6.02×1023=1.204×1022
