如图装置中,b电极用金属M制成,a、c、d为石墨电极,接通电源,金属M沉积于b极,同时a、d电极上产生气泡.试回答:
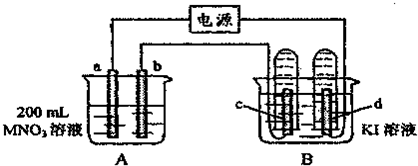
(1)a为______极,c极的电极反应式为______.
(2)电解开始时,在B烧杯的中央,滴几滴淀粉溶液,你能观察到的现象是:______,电解进行一段时间后,罩在c极上的试管中也收集到了气体,此时c极上的电极反应为______.
(3)当d极上收集到44.8mL气体(标准状况)时停止电解,a极上放出了______moL气体,若b电极上沉积金属M的质量为0.432g,则此金属的摩尔质量为______g/mol.
(4)电解停止后加蒸馏水使A烧杯中的溶液体积仍为200mL,取这种溶液加入到25.0mL 0.100mol•L-1HCl溶液中,当加入31.25mL溶液时刚好沉淀完全.试计算:电解前A烧杯中MNO3溶液的物质的量浓度.______mol•L-1.
由电解原理可得:金属M沉积于b极,说明b是阴极,则a是阳极,c是阳极,d是阴极,
(1)因a是阳极,溶液中的阴离子放电,根据离子的放电顺序,可知是I-放电:2I--2e-=I2,
故答案为:阳;2I--2e-=I2;
(2)在B烧杯中,c是阳极,溶液中的阴离子放电,即2I--2e-=I2,I2遇到淀粉能使淀粉变蓝,I-放电完毕后,
接着是OH-放电:4OH--4e=2H2O+O2↑,c极上的试管中收集到的气体为氧气,
故答案为:c极附近的溶液首先变成蓝色;4OH--4e=2H2O+O2↑;
(3)d极是溶液中氢离子放电:
2H++2e-=H2↑
0.004mol 0.044.8L 22.4L/mol
a极上氢氧根离子放电:
4OH--4e=2H2O+O2↑
0.004mol 0.001mol
即氧气的物质的量为0.001mol
b极上氢氧根离子放电:M++e-=M
0.004mol 0.004mol
则金属的摩尔质量M=
=m n
=108g/mol,0.432g 0.004mol
故答案为:0.001;108.
(4)设稀释后溶液的浓度为X,根据反应:Cl-+M+=MCl↓
0.100 mol/L×0.025L X×0.03125L
解得X=0.08mol•L-1
所以200mL电解停止后加蒸馏水稀释的溶液中,M+ 的物质的量为0.08mol•L-1×0.2L=0.016mol
则电解前A烧杯中MNO3溶液的M+ 物质的量=0.004mol+0.16mol=0.004mol+0.016mol=0.02mol
所以MNO3溶液的物质的量浓度=
mol/L=0.1mol/L,故答案为:0.1.0.02mol 0.2L
故答案为:0.1.