(15分)氢元素与氮元素可组成多种微粒,如NH3、NH4+、N2H4等。
I.(1)分析常见的H2O与H2O2、CH4与C2H6的分子结构,写出的N2H4电子式_____。
(2)某盐N2H5Cl与NH4Cl类似,是可溶于水的离子化合物,其溶液因水解而呈弱酸性。N2H5Cl溶液显酸性原因(用离子方程式表示)_______________。
(3)有七种物质:NH3、Mn2O3、ZnCl2、MnO2、NH4Cl、Zn和H2O,是锌—锰电池中氧化还原反应的某些反应物(NH4Cl为其中之一)和某些生成物(NH3为其中之一)。
写出上述化学反应方程式:_________________________。
 II.在恒温条件下,起始容积均为5L的甲、乙两密闭容器中(甲为恒容器、乙为恒压容器),均进行反应:N2+3H2 2NH3,有关数据及平衡状态特点见下表。
II.在恒温条件下,起始容积均为5L的甲、乙两密闭容器中(甲为恒容器、乙为恒压容器),均进行反应:N2+3H2 2NH3,有关数据及平衡状态特点见下表。
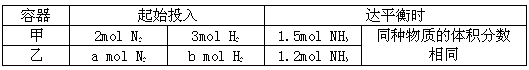
(4)下列能表明容器乙一定达平衡状态的是_____(填字母)
| A.容器内的混合气体的平均相对分子质量不再变化 | |
| B.容器内的氮元素的质量不再变化 | |
| C.氢气的生成速率与氨气的消耗速率之比为2:3
| D.形成1mol N N键的同时形成6molN—H键 |
(6)起始时,容器乙是容器甲压强的_____倍。
(15分)
Ⅰ.(1)  (2分)
(2分)
(2)N2H5++H2O N2H4·H2O+H+ (2分)
N2H4·H2O+H+ (2分)
(3)Zn+2MnO2+2 NH4Cl =ZnCl2 +Mn2O3+2NH3↑+H2O (3分)
Ⅱ.(4)AD(2分) (5)37.5% (3分) (6)0.8 (3分)

