问题
问答题
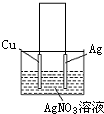
如图是利用质量相等的Cu片和Ag片及500mL AgNO3溶液组成的原电池,一段时间后,正、负两极质量差为14g,若溶液体积不变,计算:
(1)电路中转移电子的物质的量为______.
(2)溶液中AgNO3的物质的量浓度变化了______.
答案
Cu片和Ag片及500mL AgNO3溶液组成的原电池中,正极:Ag++e-→Ag,负极:Cu-2e-→Cu2+,设电路中转移电子的物质的量为n,则正极质量增加108n,负极质量减少32n,所以108n+32n=14g,解得n=0.1mol,故答案为:0.1mol;
(2)当电路中转移0.1mol电子时,根据正极反应:Ag++e-→Ag,则减少的银离子物质的量为0.1mol,C=
=n V
=0.2mol/L,所以溶液中AgNO3的物质的量浓度减少0.2mol/L,故答案为:0.2mol/L(减少).0.1mol 0.5L
