请从如图中选用必要的装置进行电解饱和食盐水的实验,要求测定产生的氢气的体积,并检验氯气.
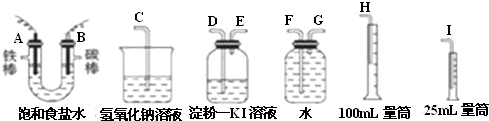
(1)A极发生的电极反应式是______B极发生的电极反应式是______
(2)设计上述气体实验装置时,各接口的正确连接顺序为:A接______、______接______;B接______、______接______.
(3)证明产物中有Cl2的实验现象是______.
(4)已知电解后测得产生的H2的体积为44.8mL(已经折算成标准状况),电解后溶液的体积为50mL,此时溶液中NaOH的物质的量浓度为______.
(5)有一和电解饱和食盐水能量转换相反的装置中,一极通入甲烷,另一极通入氧气,电解质溶液为KOH溶液,负极的反应式为______正极的反应式为______.
(1)电解饱和食盐水获得氯气时,A极是活泼金属电极,应为阴极,阴极上是氢离子得电子,
反应式为:2H++2e-=H2↑,B极是阳极,阳极是氯离子失电子的过程,反应式是:2Cl--2e-=Cl2↑,
故答案为:2H++2e-=H2↑;2Cl--2e-=Cl2↑;
(2)测定产生的氢气的体积用排水量气法,导管是短进长出,所以A接G,用装有淀粉碘化钾溶液的洗气瓶检验氯气时,导管要长进短出,所以B接D,氯气要进行尾气处理,即E接C,故答案为:G、F、H、D、E、C;
(3)氯气可以将碘化钾中的碘置换出来,生成的碘单质可使使湿润的淀粉碘化钾试纸变蓝,所以证明产物中有Cl2的实验现象是湿润的淀粉碘化钾试纸变蓝,故答案为:湿润的淀粉碘化钾试纸变蓝;
(4)根据电解饱和食盐水的电解原理方程式:2NaCl+2H2O
2NaOH+H2↑+Cl2↑,当产生的H2的体积为44.8mL0.002mol时,生成氢氧化钠的物质的量为0.004mol,所以溶液中NaOH的物质的量浓度= 通电 .
=0.08mol/L,0.004mol 0.05L
故答案为:0.08mol/L;
(5)在甲烷燃料电池中,负极上失电子的是燃料甲烷,在碱性环境下电极反应为:CH4-8e-+10OH-=CO32-+7H2O,正极上得电子的是氧气,在碱性环境下电极反应为:2O2+8e-+4 H2O=8OH-,
故答案为:CH4-8e-+10OH-=CO32-+7H2O;2O2+8e-+4 H2O=8OH-.
