问题
选择题
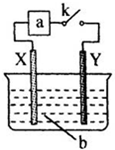
如图:X为铁棒,Y为铜棒,当K闭合后,下列有关分析不正确的是( )
A.当a为电流表,b为浓硝酸时:Y为负极
B.当a为电流表,b为稀硫酸时:X电极反应为:Fe-2e-═Fe2+
C.当a为直流电源,b为CuSO4溶液时:X、Y两电极附近的S
浓度相等O 2-4
D.当a为直流电源,b为NaOH溶液,X极附近产生白色沉淀时:电子从X极流入a
答案
A、当电解质溶液为浓硝酸时,常温下,铁能与浓硝酸发生钝化现象而阻止了铁与浓硝酸进一步的反应,铜与浓硝酸能自发的进行氧化还原反应,所以铜作负极,铁作正极,即Y为负极,故A正确.
B、当电解质溶液为稀硫酸时,铁能与稀硫酸自发的进行氧化还原反应,铜不与稀硫酸反应,所以铁作负极,铜作正极,负极上失电子发生氧化反应,X电极上发生的电极反应式为Fe-2e-═Fe2+,故B正确.
C、当a为直流电源,b为CuSO4溶液时,电解池工作时,电解质溶液中阳离子向阴极移动,阴离子向阳极移动,所以两极附近的SO42-浓度不相等,故C错误.
D、电解池工作时,b为NaOH溶液,X极附近产生白色沉淀时,说明X极铁失电子生成二价铁离子进入溶液,铁作阳极,铜作阴极,电子从X极流入a即电子从阳极流向正极,故D正确.
故选C.
