下列装置中,a5是铁电极,其余为石墨电极,烧杯中液体体积均为100mL,放置一段时间后,有关叙述不正确的是(不考虑溶液体
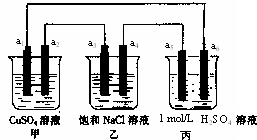
积变化)( )
A.a2电极上有亮红色固体
B.a1、a3电极上产生的物质,物质的量比是1:2
C.丙中的SO42-向a6电极移动
D.当装置电路中有6.02×1021个电子通过时,乙中溶液的pH是13
丙装置中能自发的进行氧化还原反应,符合原电池的构成条件,甲和乙装置不能自发的进行氧化还原反应,所以丙是原电池,甲和乙有外接电源,所以构成电解池.
A、钾装置中a1是阳极,a2是阴极,阴极上铜离子放电析出铜单质,所以有亮红色物质生成,故A正确.
B、a1、a3电极上产生的物质分别是氧气、氯气,生成一个氧气分子需要氢氧根离子失去4个电子,生成一个氯气分子需要2个氯离子失去2个电子,根据失电子个数相等知,生成氧气和氯气的物质的量之比为1:2,故B正确.
C、丙装置中,铁作负极,石墨作正极,原电池放电时,溶液中阴离子向负极移动,即向a5移动,故C错误.
D、乙装置中阴极上氢离子放电,阳极上氯离子放电,电池反应式为
2NaCl+2H2O
Cl2↑+H2↑+2NaOH 转移电子 电解 .
2mol 2×6.02×1023
0.01mol 6.02×1021
生成氢氧化钠的物质的量是0.01mol,氢氧化钠的物质的量浓度是0.1mol/L,所以溶液的PH=13,故D正确.
故选C
