将洁净的金属片A、B、C、D分别放置在浸有盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录图中电压表指针的移动方向和电压表的读数如下:
| 金属 | 电子流动方向 | 电压/V |
| A | A→Cu | +0.78 |
| B | Cu→B | -0.15 |
| C | C→Cu | +1.35 |
| D | D→Cu | +0.30 |
(1)______金属可能是最强的还原剂;______金属一定不能从硫酸铜溶液中置换出铜.
(2)若滤纸不用盐溶液浸润而改用NaOH溶液浸润,则在滤纸上能看到有蓝色沉淀析出的金属是______(填字母).其对应电池的电极反应式为:负极:______; 正极:______.
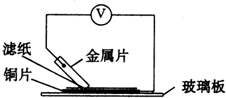
A-Cu连接时,电子从A→Cu,所以A的金属性大于铜;
B--Cu连接时,电子从Cu→B,所以铜的金属性大于B;
C--Cu连接时,电子从C→Cu,所以C的金属性大于铜;
D--Cu连接时,电子从D→Cu,所以D的金属性大于铜;
(1)根据题中信息和原电池原理,电子流出的一极是原电池的负极,是相对活泼的金属,所以A、C、D都比Cu活泼,金属活动性差值越大,电压表的示数越大.所以C最活泼,而活泼性比Cu差的是B.故答案为:C;B;
(2)滤纸改为用NaOH溶液浸润,若生成蓝色沉淀[Cu(OH)2],说明Cu作负极,则B作正极,
负极反应为:2Cu+4OH--4e-═2Cu(OH)2↓;正极反应为:2H2O+O2+4e-═4OH-.
故答案为:B;2Cu+4OH--4e-═2Cu(OH)2↓;2H2O+O2+4e-═4OH-.