看图回答下列问题
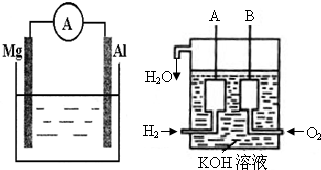
(1)若烧杯中溶液为稀硫酸,则观察到的现象是______,电流表指针______(填偏转或不偏转),两极反应式为:正极______;负极______.
(2)若烧杯中溶液为氢氧化钠溶液,则负极为______(填Mg或Al),总反应方程式为______
(3)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如图所示:A、B两个电极均由多孔的碳块组成.该电池的正极反应式为:______.
(4)如果将上述装置中通入的H2改成CH4气体,也可以组成一个原电 池装置,电池的总反应方程式为:CH4+2O2+2KOH=K2CO3+3H2O,则该电池的负极反应式为:______.
(1)镁、铝和稀硫酸构成了原电池,自发进行的反应是镁和硫酸反应,金属镁做负极,
电极反应:Mg-2e-=Mg2+,金属铝为正极,溶液中的2H+得到电子发生还原反应,电极反应为:2H++2e-=H2↑,
所以可看到镁逐渐溶解,铝极上有气泡冒出,电流表指针发生偏转,
故答案为:镁逐渐溶解,铝极上有气泡冒出;电流表指针发生偏转;Mg-2e-=Mg2+;2H++2e-=H2↑.
(2)镁、铝和氢氧化钠溶液构成了原电池,自发的氧化还原反应是金属铝和氢氧化钠之间的反应,总反应方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,铝失电子,为负极,金属镁作正极,
故答案为:Al;2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(3氢气、氧气和氢氧化钾溶液构成了原电池,自发的氧化还原反应是氢气和氧气之间的反应,总反应方程式为
:2H2+O2=2H2O,,正极上通的是氧气,B极是正极,电极反应:O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-
(4)燃料电池的总反应离子方程式为:CH4+2O2+2OH-=CO32-+3H2O,正极上通的是氧气,电极反应:2O2+4H2O+8e-=8OH-,负的极一定是燃料失电子的过程,因正极和负极相加即为总反应,所以:CH4+8e-+10OH-=CO32-+7H2O,
故答案为:CH4+8e-+10OH-=CO32-+7H2O.
