回答下列各题:
(1)在探究原电池中电极与电解质溶液之间的关系时,某同学设计了用铝片、铜片作电极,用浓硝酸作电解质溶液的原电池,则铜片为原电池的______极,铝片上的电极反应式为______.
(2)通过______装置( 填“原电池”或“电解池”)可以实现如下反应:
Cu+2H2O═Cu(OH)2+H2↑
该装置应以铜为______极,并可选用下列溶液中的______为电解质溶液(填符号).
A.H2SO4溶液 B.NaOH溶液 C.CuSO4溶液 D.NaCl溶液
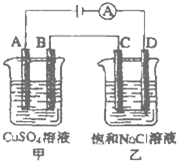
(3)如图所示的两个电解槽中,A、B、C、D均为石墨电极.电解过程中,乙中反应的离子方程式为______.
若乙烧杯中D极上产生224mL标准状况下的气体,则甲烧杯中B极上可析出铜______g(铜的相对原子质量为64).
(1)铝片、铜片、浓硝酸构成的原电池中,常温下,铝片能与浓硝酸发生钝化现象,铜能与浓硝酸自发的发生氧化还原反应,铜片作负极,铝片作正极,正极上硝酸根离子得电子和氢离子生成二氧化氮和水,电极反应式为4H++2NO3-+2e-=2NO2↑+2H2O,
故答案为:负极;4H++2NO3-+2e-=2NO2↑+2H2O;
(2)Cu+2H2O═Cu(OH)2+H2↑该反应不能自发的进行氧化还原反应,所以不能构成原电池只能构成电解池,利用外接电源使其强制发生氧化还原反应.
该反应中铜失电子发生氧化反应,所以铜片作阳极,阴极上水分子放电生成氢气和氢氧根离子,发生还原反应.
A.如果电解硫酸溶液,阴极上先氢离子放电生成氢气,随着反应的进行,阳极上生成的铜离子进入溶液,后阴极上铜离子放电不是氢离子放电,故A错误;
B、电解氢氧化钠溶液时,阴极上氢离子放电,阳极上生成的铜离子和氢氧根离子生成氢氧化铜沉淀,所以阴极上始终没有铜离子得电子,故B正确;
C、电解硫酸铜溶液时,阴极上铜离子放电生成铜单质,不是氢离子放电,故C错误;
D.电解NaCl溶液时,阴极上氢离子放电同时生成氢氧根离子,阳极上生成的铜离子和氢氧根离子反应生成氢氧化铜沉淀,符合电池反应式,故D正确;
故答案为:电解池;阳极;BD;
(3)电解时,乙中阳极上氯离子失电子生成氯气,阴极上氢离子得电子生成氢气,所以电池反应式为:2Cl-+2H2O=Cl2↑+H2↑+2OH-,
乙烧杯中D极连接电源的负极,所以D极作阴极,D极上氢离子得电子生成氢气,电极反应式为:2H2O+2e-=H2↑+2OH-,
甲烧杯中B作阴极,阴极上铜离子得电子生成铜单质,电极反应式为2Cu2++2e-=Cu,
根据电解池工作时,阴阳极上得失电子相等,
设生成铜的质量为X,氢气和铜的关系式为
Cu--H2↑
64g 22.4L
X 0.224L
x=0.64g
故答案为:2Cl-+2H2O=Cl2↑+H2↑+2OH-;0.64g.
