问题
选择题
下列说法不正确的是( )
A.
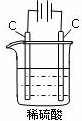
通电一段时间后,搅拌均匀,溶液的pH增大
B.
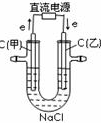
甲电极上的电极反应为:AB2Cl--2e-═Cl2↑
C.

Pt电极上的电极反应为:O2+2H2O+4e-═4OH-
D.
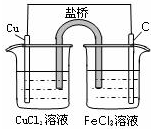
总反应的离子方程式为:2Fe3++Cu═Cu2++2Fe2+
答案
A、该装置是电解池,阳极上氢氧根离子放电生成氧气,阴极上氢离子放电生成氢气,实际上电解的是水,导致溶液中氢离子浓度增大,溶液的PH值变小,故A错误;
B、该装置是电解池,直流电源上电子流出的一极是负极,电子流入的一极是正极,所以甲电极是阳极,阳极上氯离子放电生成氯气,电极反应式为:2Cl--2e-=Cl2 ↑,故B正确;
C、该装置是原电池,铁作负极,铂作正极,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为:O2+2H2O+4e-═4OH-,故C正确;
D、该装置是原电池,铜作负极,碳作正极,负极上铜失电子生成铜离子Cu-2e-=Cu2+,正极上三价铁离子得电子生成二价铁离子2Fe3++2e-=2Fe2+,将两个电极反应式相加得2Fe3++Cu═Cu2++2Fe2+,故D正确.
故选A.
