用酸性氢氧燃料电池电解硫酸钠饱和溶液的装置如图所示 (a、b为铜电极).下列说法中不正确的是( )
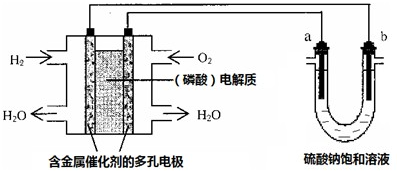
A.电池工作时,正极反应式为:O2+4H++4e-=2H2O
B.电解时,当阴极逸出amol气体,同时有W克Na2SO4﹒10H2O析出,保持温度不变,剩余溶液中的硫酸钠的质量分数是

C.电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极
D.忽略能量损耗,当电池中消耗0.02gH2时,b极周围会产生0.02gH2
A、左边装置是氢氧燃料电池,所以是原电池;原电池放电时,正极上氧化剂得电子发生还原反应,即氧气得电子和氢离子反应生成水,电极反应式为O2+4H++4e-=2H2O,故A正确.
B、电解时,阴极上析出的是氢气,当阴极逸出amol气体电解的水的质量为:
2H2O
O2↑+2H2↑, 电解 .
36g 2mol
18ag amol
所以当阴极逸出amol气体电解的水的质量为18ag,电解后的溶液仍为饱和溶液,溶液的质量分数为:
×100%=
×100%×W142 142+180 W+18a
×100%,故B错误.71W 161(W+18a)
C、电子在导线中移动,不能在溶液中移动,故C错误;
D、燃料电池和电解池中转移的电子数是相等的,当电池中消耗0.02gH2,根据电极反应:H2→2H++2e-,所以转移电子0.02mol,b极的电极反应为:2H++2e-→H2,转移电子0.02mol,会产生0.02gH2,故D正确.
故选BC.
