某课外活动小组同学用右图装置进行实验,一段时间后在C电极表面有铜析出,试回答下列问题.
(1)A为电源的______极;
(2)E的电极反应式为:______;
(3)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为______;
(4)在常温下,现用丙装置给铁镀铜,则H电极材料应该是______,当丙中铁表面析出铜的3.2g时,乙中溶液的PH值为______(假设溶液体积为1L);
(5)在电解一段时间后在甲中加入适量______可以使溶液恢复到原来的浓度.
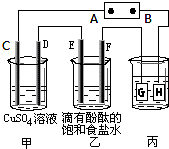
(1)C电极上有铜析出,C电极上发生还原反应,所以C电极是阴极,连接阴极的是负极,所以A为负极,故答案为:负极.
(2)C是阴极,则D是阳极,E是阴极,F是阳极,阳离子在阴极上发生还原反应,溶液中氢离子的放电能力大于钠离子,所以氢离子放电,故答案为:2H++2e-=H2↑
(3)根据离子的放电顺序判断,甲、乙装置中C、D、E、F四个电极上分别生成的物质是Cu、O2、H2、
Cl2,根据得失电子数相等,这四种物质间的关系式为 2Cu--O2--2 H2--2Cl2,根据物质的量之比等于计量数之比知,物质的量之比为2:1:2:2,故答案为:2:1:2:2.
(4)根据题意知,G为阴极,H为阳极;根据电镀原理,镀层在阳极,镀件在阴极,所以H电极材料应该是铜;
乙装置中的氢气来源于水,一个水分子电离成一个氢离子和一个氢氧根离子,两个氢离子生成一个氢分子,所以氢分子和氢氧根离子的关系式为 H2 --2 OH -;根据得失电子数相等,丙装置中析出的铜与乙装置中氢气的关系式为
Cu--H2;所以氢氧根离子和铜的关系式为
Cu--2 OH -
64g 2mol
3.2g 0.1mol
所以C(OH-)=0.1 mol/L,则C(H+)=1×10-13 mol/L,所以PH=13,故答案为:铜;13;
(5)甲装置中电解反应方程式为 2CuSO4+2H2O
2Cu+O2↑+2H2SO4 电解 .
由方程式知,电解出的物质有铜和氧气,所以加入氧化铜即可,故答案为:CuO(若考虑到水开始电解Cu(OH)2也可以)