问题
选择题
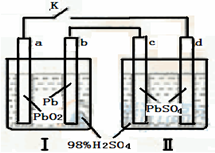
铅蓄电池的工作原理为Pb+PbO2+2H2SO
2PbSO4+2H2O,根据图,下列判断不正确的是( ) 通电 .
A.K闭合时,d电极反应式:PbSO4+2H2O-2e-=PbO2+4H++SO42-
B.K闭合时,Ⅱ中SO42-向d电极迁移
C.K闭合一段时间后,Ⅱ可单独作为原电池,d电极为正极
D.当电路中转移0.2mol电子时,Ⅰ中消耗的H2SO4为0.4mol
答案
A、K闭合时,Ⅰ装置是一个原电池,a是正极,b是负极,Ⅱ是一个电解池,c是阴极,d是阳极,阳极发生失电子的氧化反应,电极反应为PbSO4+2H2O-2e-=PbO2+4H++SO42-,故A正确;
B、K闭合时,Ⅱ中是电解硫酸的装置,c是阴极,d是阳极,在电解池中,阴离子移向阳极,即移向d极,故B正确;
C、K闭合一段时间后,Ⅱ中的d电极上析出PbO2,c电极上析出金属Pb,此时Ⅱ可单独作为原电池,析出铅的电极是负极,故c正确;
D、根据电极反应Pb+PbO2+2H2SO
2PbSO4+2H2O,当电路中转移2mol电子时化学反应中消耗硫酸2mol,所以当电路中转移0.2mol电子时,Ⅰ中消耗的H2SO4为0.2mol,故D错误. 通电 .
故选D.
