民间流传用硝土和草木灰作原料来制取硝酸钾.硝土中含有硝酸钙和氯化钠物质,草木灰的主要成分是碳酸钾.制作的主要工艺流程如图所示:
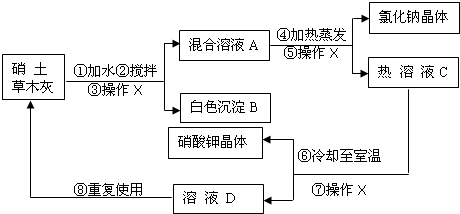
(1)③⑤⑦均为操作X,该操作是______;
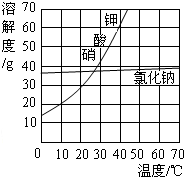
(2)结合图,分析工艺流程中用加热蒸发方法得到氯化钠晶体,而用冷却结晶法得到硝酸钾晶体的原因______.
(3)写出生成白色沉淀B的化学方程式:______.
(4)用含硝酸钙为50%的硝土40kg与草木灰混合,按上述工艺流程,理论上能制取硝酸钾的质量是______kg(保留1位小数).
(5)溶液D可以重复使用的原因是______.
(1))③⑤⑦均为操作X,该操作是将固体和液体分开,为过滤;
(2)用加热蒸发方法得到氯化钠晶体,而用冷却结晶法得到硝酸钾晶体的原因:NaCl的溶解度受温度变化的影响较小,而KNO3的溶解度受温度变化的影响较大.
(3)硝酸钙与碳酸钾反应生成碳酸钙沉淀和硝酸钾,所以生成白色沉淀B的化学方程式:Ca(NO3)2+K2CO3═CaCO3↓+2KNO3
(4)已知硝酸钙为50%的硝土40kg,则硝酸钙为20kg,根据化学方程式Ca(NO3)2+K2CO3═CaCO3↓+2KNO3设理论上能制取硝酸钾的质量为x,列比例式
=164 20
,解得x≈24.6kg;202 x
(5)溶液D可以重复使用的原因是:滤液中仍有较多的KNO3
故答为:(1)过滤;(2)NaCl的溶解度受温度变化的影响较小,而KNO3的溶解度受温度变化的影响较大.
(3)Ca(NO3)2+K2CO3═CaCO3↓+2KNO3;(4)24.6kg
(5)滤液中仍有较多的KNO3(或重复利用滤液中的KNO3,节约原料,提高原料的利用率)
