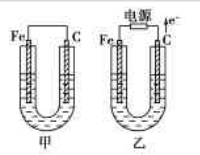
甲、乙两池电极材料如图所示.
请按要求回答下列问题:
(1)若两池中均为CuSO4溶液,反应一段时间后:①有红色物质析出的是:甲池中的______棒(填“铁”或“碳”)、乙池中的______极(填“阴”或“阳”);
②乙池中阳极电极反应式是______.
(2)若两池中均为足量饱和NaCl溶液:
①写出乙池中总反应的化学方程式______;
若电极上转移0.2mole-,则阴极上生成______mol气体;再加入______(填化学式)可恢复到原来浓度.
②甲池中碳极上电极反应式是______,其原理与金属的______腐蚀原理相同;若要防止铁的腐蚀可采取的措施为______(填序号).
a.将甲图碳棒换成铜棒
b.碳棒换成锌棒
c.在铁、碳之间连接一个直流电源,把铁接到负极上
d.把铁接到直流电源的正极上.
(1)①甲池为原电池,原电池中活泼金属做负极,发生氧化反应,碳棒做正极,有Cu析出,乙池为电解池,阴极发生还原反应有Cu析出,故答案为:碳;阴;
②电解质溶液中的铜离子在原电池正极析出,在电解池阴极析出;惰性电极电解硫酸铜溶液,阳极氢氧根离子放电生成氧气,电极反应为4OH-4e-=2H2O+O2↑,
故答案为:4OH-4e-=2H2O+O2↑;
(2)①若电解质溶液为饱和氯化钠溶液,则乙池就是用惰性电极电解氯化钠溶液,方程式为2NaCl+2H2O
Cl2↑+H2↑+2NaOH, 电解 .
若电极上转移0.2mole-,则阴极生成0.1mol氢气,阳极生成0.1mol氯气,若要恢复电解质溶液浓度,只需加入0.2molHCl即可,
故答案为:2NaCl+2H2O
Cl2↑+H2↑+2NaOH;0.1mol;HCl; 电解 .
②甲池中碳棒为正极,发生还原反应,氧气得到电子生成氢氧根,与吸氧腐蚀的电极反应相同,用电化学方法防止金属腐蚀就要让被保护的金属做原电池的正极或电解池的阴极.
故答案为:O2+2H2O+4e-=4OH-;吸氧;b、c.
