问题
选择题
根据如图所示的装置,判断下列说法正确的是( )
A.该装置中a极为负极
B.当装置中某一块铜片的质量变化了12.8 g时,a极上消耗的O2在标准状况下的体积为4.48 L
C.该装置中b极的电极反应式是:H2-2e-=2H+
D.一段时间后,左边装置中溶液pH减小
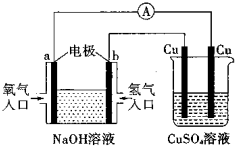
答案
A.由图可知,左端为燃料电池,通入氢气的一极为电源的负极,即b为负极,故A错误;
B.由2Cu~4e-~O2↑,某一块铜片的质量变化了12.8 g时,n(Cu)=
=0.2mol,所以a极上消耗的O2在标准状况下的体积为0.1mol×22.4L/mol=2.24L,故B错误;12.8g 64g/mol
C.氢氧燃料电池中,通入氧气的b极为原电池的正极,发生得电子得还原反应,即2H2O+4e-+O2=4OH-,故C错误;
D.氢氧燃料电池反应产物是水,NaOH溶液的浓度变小,则pH减小,故D正确;
故选D.
