问题
选择题
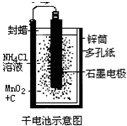
普通锌锰干电池的简图(如图所示),它是用锌皮制成的锌筒作电极兼做容器,中央插一根碳棒,碳棒顶端加一铜帽.在石墨碳棒周围填满二氧化锰和炭黑的混合物,并用离子可以通过的长纤维纸包裹作隔膜,隔膜外是用氯化锌、氯化铵和淀粉等调成糊状作电解质溶液;该电池工作时的总反应为:
Zn+2NH4++2MnO2=[Zn(NH3)2]2++Mn2O3+H2O
关于锌锰干电池的下列说法中正确的是( )
A.当该电池电压逐渐下降后,利用电解原理能重新充电复原
B.电池正极的电极反应式为:2MnO2+2NH4++2e-═Mn2O3+2NH3+H2O
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.1mol电子,锌的质量理论上减小6.5g
答案
A、一次电池不能重复使用,二次电池能重复使用,干电池是一次电池,所以当该电池电压逐渐下降后,不能利用电解原理能重新充电复原,故A错误.
B、该原电池放电时,正极上二氧化锰得电子发生还原反应,电极反应式为:2MnO2+2NH4++2e-═Mn2O3+2NH3+H2O,故B正确.
C、原电池工作时,负极上失电子发生氧化反应,正极上得电子发生还原反应,电子从负极沿导线流向正极,故C错误.
D、Zn+2NH4++2MnO2=[Zn(NH3)2]2++Mn2O3+H2O 转移电子
65g 2mol
3,25g 0.1mol
所以外电路中每通过0.1mol电子,锌的质量理论上减小3.25g,故D错误.
故选B.
