问题
填空题
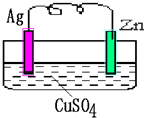
如图所示的原电池,一段时间后某极析出1.28克的固体.求:
(1)正极是______(填“锌”或“银),发生______反应
(2)正极的电极反应为______;
(3)上述过程中共需转移电子______mol.
(4)锌片的质量______(填”增加”或”减少”)______克.
答案
(1)该原电池中,锌的活泼性大于银,所以锌失电子发生氧化反应,锌作负极;银作正极,溶液中铜离子得电子,发生还原反应.
故答案为:银;还原.
(2)正极上,铜离子得电子生成铜,所以析出的固体为铜,电极反应式为Cu2++2e-=Cu.
故答案为:Cu2++2e-=Cu.
(3)该原电池的电池反应式为:Zn+CuSO4=ZnSO4+Cu 转移电子
64g 2mol
1.28g 0.04 mol
所以转移电子 0.04mol
故答案为:0.04.
(4)锌作负极,锌失电子变成锌离子进入溶液,所以质量逐渐减少;
Zn+CuSO4=ZnSO4+Cu
65g 64g
1.3g 1.28g
所以锌质量减少1.3g.
故答案为:减少;1.3.
