如图所示的电解装置中,乙池盛有20OmL饱和CuSO4溶液,丙池盛有2OOmL饱和NaCl溶液.通电一段时间后,C极增重0.64g,则:
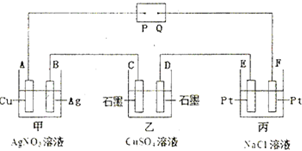
(1)P是电源的______极.
(2)甲池中,A极的质量______(填“增加”或“减少”)______g.电解一段时间,甲池溶液的pH______(填“变大”、“变小”或“不变”).
(3)D极的电极反应式为______,丙池电解反应的离子方程式为______,相同状况下,D电极与E电极产生的气体体积比为______.
(4)电解后,乙、丙电池中溶液的pH分别为乙______、丙______(设溶液体积不变,温度为室温,也不考虑溶液的水解).
(5)若乙池溶液通电一段时间后,向所得的溶液中加入0.1mol的Cu(OH)2后恰好恢复到电解前的浓度.则电解过程中转移电子的数目为______.(用NA表示)
(1)乙池盛有20OmL饱和CuSO4溶液,C极增重0.64g,则C极发生Cu2++2e-=Cu,即C极为阴极,由图可知,P为负极,故答案为:负;
(2)甲中A电极发生Ag++e-=Ag,则A电极质量增加,由Cu~2e-~2Ag,则Ag的质量为
×2×108g/mol=2.16g,硝酸银溶液的浓度不变,则pH不变,0.64g 64g/mol
故答案为:增加;2.16;不变;
(3)乙中D为阳极,发生的电极反应为4OH--4e-=2H2O+O2↑,丙中发生2NaCl+2H2O
2NaOH+H2↑+Cl2↑,其离子反应为2Cl-+2H2O 电解 .
2OH-+H2↑+Cl2↑,E电极为氢气, 电解 .
由电子守恒可知O2~2H2,则D电极与E电极产生的气体体积比为1:2,
故答案为:4OH--4e-=2H2O+O2↑;2Cl-+2H2O
2OH-+H2↑+Cl2↑;1:2; 电解 .
(4)由电子守恒可知,乙中Cu~H2SO4,则c(H+)=
=0.1mol/L,其pH=1;由电子守恒可知丙中Cu~2NaOH,则c(OH-)=0.01mol×2 0.2L
=0.1mol/L,其pH=13,0.01mol×2 0.2L
故答案为:1;13;
(5)乙池溶液通电一段时间后,向所得的溶液中加入0.1mol的Cu(OH)2后恰好恢复到电解前的浓度,发生2CuSO4+2H2O
2Cu+O2↑+2H2SO4、2H2O 电解 .
2H2↑+O2↑, 电解 .
由Cu(OH)2
CuO+H2O,则转移的电子数为(0.1mol×2+0.1mol×2)×NA=0.4NA,故答案为:0.4NA. △ .
