甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:
(1)若两池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的______棒,乙池中的______棒.
②乙池中阳极的电极反应式是______.
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式______.
②甲池中碳极上电极反应式是______,乙池碳极上电极反应属于______(填“氧化反应”或“还原反应”).
③将湿润的淀粉KI试纸放在乙池碳极附近,发现试纸变蓝,待一段时间后又发现蓝色褪去.这是因为过量的Cl2将生成的I2又氧化.若反应的Cl2和I2物质的量之比为5:1,且生成两种酸,该反应的化学方程式为______.
④若乙池转移0.02mol e-后停止实验,池中溶液体积是200mL,测溶液混匀后的pH=______.
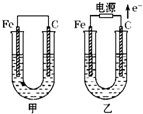
甲装置是原电池,较活泼的金属铁作负极,碳作正极,乙有外接电源属于电解池,根据电子的流向知,碳是阳极,铁是阴极,阳极上失电子发生氧化反应;
(1)若两池中均为CuSO4溶液,反应一段时间后,①甲池中,正极上铜离子得电子而析出铜,乙池中,阴极铁棒上铜离子得电子而析出铜;
②乙池中阳极上,氢氧根离子失电子生成氧气和水,电极反应式为:4OH--4e-=2H2O+O2↑,
故答案为:①碳、铁,②4OH--4e-=2H2O+O2↑,
(2)若两池中均为饱和NaCl溶液,
①电解氯化钠溶液时,阳极上氯离子失电子生成氯气,阴极上水得电子生成氢气 和氢氧根离子,所以电池反应式为:2Cl-+2H2O
Cl2↑+H2↑+2OH-, 电解 .
故答案为:2Cl-+2H2O
Cl2↑+H2↑+2OH-; 电解 .
②甲池中碳极上氧气得电子和水反应生成氢氧根离子,电极反应式为2H2O+O2+4e-=4OH-,
乙池碳极上氯离子失电子发生氧化反应,
故答案为:2H2O+O2+4e-=4OH-,氧化反应;
③过量的Cl2将生成的I2又氧化,氯气被还原生成氯离子,1mol氯气被还原得到2mol电子,若反应的Cl2和I2物质的量之比为5:1,且生成两种酸,根据得失电子数相等知,含碘的酸中碘的化合价是+5价,所以含碘的酸是碘酸,故氯气和碘、水反应生成盐酸和碘酸,反应方程式为:5Cl2+I2+6H2O=2HIO3+10HCl,
故答案为:5Cl2+I2+6H2O=2HIO3+10HCl;
④设生成氢氧化钠的浓度是Cmol/L,
2Cl-+2H2O
Cl2↑+H2↑+2OH-转移电子 电解 .
2mol 2mol
0.2Cmol 0.02mol
C=
=0.1,即氢氧化钠的物质的量浓度是0.1mol/L,则溶液的pH=13,2mol×0.02mol 2mol×0.2mol
答:氢氧化钠溶液的pH=13.
