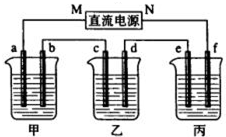
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放109g5.51%的NaOH溶液、足量的CuSO4溶液和200g10.00%的K2SO4溶液.电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
(1)电极b上发生的电极反应为______.
(2)电极b上生成的气体在标状况下的体积为______,此时甲烧杯中NaOH溶液的物质的量浓度为(设溶液的密度为1g/cm3)______.
(3)电极c的质量变化是______g,欲使电解后乙中的电解液恢复到起始状态,应该向溶液中加入适量的______(填字母编号).
A.Cu(OH)2 B.Cu2O C.CuCO3 D.Cu2(OH)2CO3
(4)其他条件不变,如果把乙装置改为电解精炼铜,则c电极的材料为______,d电极的材料为______.
(1)甲为5.51%的NaOH溶液,b为阳极,阳极上氢氧根离子放电生成氧气,电极方程式为4OH--4e-=2H2O+O2↑,故答案为:4OH--4e-=2H2O+O2↑;
(2)丙为200g10.00%的K2SO4溶液,通电时为电解水,其中m(K2SO4)=200g×10.00%=20g,
接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,设溶液的质量为m,则m×10.47%=20g,m=191g,电解水的质量为200g-191g=9g,n(H2O)=0.5mol,
由2H2O
2H2↑+O2↑可知转移电子1mol电子, 通电 .
电极b方程式为4OH--4e-=2H2O+O2↑,转移1mol电子,生成0.25molO2,体积为5.6L,
甲也为电解水的电解装置,应减少水9g,则电解后NaOH溶液的质量为109g-9g=100g,体积为0.1L,
又n(NaOH)=
=0.15mol,109g×5.51% 40g/mol
则c(NaOH)=
=1.5mol/L,0.15mol 0.1L
故答案为:5.6 L;1.5mol/L;
(3)电极c反应为Cu2++2e-=Cu,转移1mol电子生成0.5molCu,质量为32g,
电解硫酸铜溶液时阳极生成氧气,阴极生成铜,则欲使电解后乙中的电解液恢复到起始状态,应该向溶液中加入适量的CuO,
故答案为:32; C;
(4)把乙装置改为电解精炼铜,阴极应为纯铜,阳极为粗铜,故答案为:精铜或纯铜;粗铜.