如图是一个化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O
(1)请回答下列电极的名称:B(石墨)电极的名称是______.
(2)写出电极反应式:
通入O2的电极的电极反应式是______.
A(Fe)电极的电极反应式为______,
(3)乙池中反应的化学方程式为______.
(4)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2______mL(标准状况下)
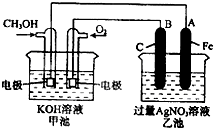
(1)根据反应方程式知,甲装置是一个燃料电池,所以甲是把化学能转变为电能的装置,是原电池;乙有外加电源,所以是电解池.根据2CH3OH+3O2+4KOH=2K2CO3+6H2O知,CH3OH发生氧化反应,所以该电极是负极,O2 发生还原反应,所以该电极是正极;石墨与原电池的正极相连,所以B石墨电极是阳极.
故答案为:阳极;
(2)根据2CH3OH+3O2+4KOH=2K2CO3+6H2O知,CH3OH发生氧化反应,所以该电极是负极,O2 得电子和水反应生成氢氧根离子,发生还原反应,所以该电极是正极;石墨与原电池的正极相连,所以石墨电极是阳极该电极上发生氧化反应,电极反应为:O2+2H2O+4e-=4OH-;铁电极是阴极,该电极上银离子得电子发生还原反应,电极反应为:4Ag++4e-=4Ag;
故答案为:O2+2H2O+4e-=4OH-;4Ag++4e-=4Ag;
(3)乙池中离子放电顺序为:阳离子 Ag+>H+,阴离子OH->NO3 -,阴极电极反应为:O2+2H2O+4e-=4OH-;阳极电极反应为:4Ag++4e-=4Ag;依据电子守恒和电解的实质写出化学方程式:4AgNO4+2H2O
4Ag+O2↑+4HNO3 通电 .
故答案为:4AgNO4+2H2O
4Ag+O2↑+4HNO3; 通电 .
(4)乙池中A(Fe)极是阴极,阴极的质量增加5.40g是银,根据得失电子数相等,氧气与银的关系式为:
O2--------4Ag
22.4L ( 4×108 )g
280mL 5.40g
故答案为:280.
