以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图:
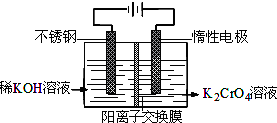
下列说法不正确的是( )
A.在阴极区,发生的电极反应为:2H2O+2e-═2OH-+H2↑
B.在阳极区,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2Cr
+2H+═Cr2O -4
+H2O向右移动O 2-7
C.该制备过程总反应的化学方程式为:4K2CrO4+4H2O
2K2Cr2O7+4KOH+2H2↑+2O2↑ 通电 .
D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比为d,则此时铬酸钾的转化率为α=d 2
A、根据题意可知:电极均为惰性电极,在阴极室,水得电子变成氢气,电极反应为:2H2O+2e-=2OH-+H2↑,故A正确;
B、阳极室水失去电子,电极反应为:2H2O-4e-=4H++O2↑,使阳极区氢离子浓度增大,平衡右移,故B正确;
C、总制备方程式为4K2CrO4 +4H2O
2K2Cr2O7 +4KOH+2H2↑+O2↑,故C正确; 电解 .
D、设加入反应容器内的K2CrO4为1mol,反应过程中有xmol K2CrO4转化为K2Cr2O4,则阳极区剩余K2CrO4为(1-x)mol,对应的n(K)=2(1-x)mol,n(Cr)=(1-x)mol,生成的K2Cr2O4为
mol,对应的n(K)=xmol,n(Cr)=xmol,根据:K与Cr的物质的量之比为d,解得x=2-d,转化率为x 2
×100%=2=d,故D错误;2-d 1
故选D.
