利用反应:2Ag(aq)+Fe(s)=Fe2+(aq)+2Ag(s)设计原电池并用它作电源进行电解的装置如图所示.NaCl溶液的体积为200mL,假设反应产生的气体全部放出,且反应前后溶液体积的变化忽略不计.下列有关叙述错误的是( )
A.电极A应该用Fe作材料,B是AgNO3溶液,电极C周围溶液变红
B.A、C两极都发生氧化反应,C电极反应式为:2H++2e-=H2↑
C.银电极变粗,为电源的正极,A电极反应式为:Fe-2e-=Fe2+
D.当析出Ag21.6g时,NaCl溶液的pH是反应前的2倍
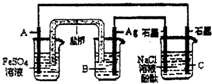
A、正极是Ag作材料,则电极A用铁作负极,电解质溶液为AgNO3溶液,电解NaCl溶液时,C是电解池的阴极,发生的反应为2H++2e-═H2↑,或为2H2O+2e-═H2↑+2OH-,
加入酚酞变红,故A正确;
B、A极是原电池的负极,发生氧化反应,C极是电解池的阴极,发生还原反应,故B错误;
C、原电池中,A极是原电池的负极,发生的反应为:Fe-2e-=Fe2+,正极是Ag作材料,电解质溶液为AgNO3溶液,发生的反应为:Ag++e-=Ag,故C正确;
D、当析出Ag21.6g时,n(Ag)═
═0.2mol,转移电子0.2mol,根据2H2O+2e-═H2↑+2OH-,可以判断出生成n(OH-)═0.2mol,则c(OH-)═21.6g 108g/mol
═1mol/L,0.2mol 0.2L
故溶液的PH═14,是反应前的2倍.故D正确.
故选B.
