问题
问答题
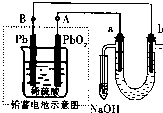
用铅蓄电池(总反应:Pb+PbO2+4H++2SO42-
2PbSO4+2H2O电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极).下列说法中正确的是( )放电 充电
A.铅蓄电池放电时的正极反应是:PbO2+4H++2SO42-=PbSO4+2H2O
B.电解苦卤水时,a电极首先放电的是Br-而不是Cl-,说明当其它条件相同时Br-的还原性强于Cl-
C.铅蓄电池充电时,A极应与外接电源负极相连
D.忽略能量消耗,当b极产生0.02g气体时,铅蓄电池中消耗0.01 mol H2SO4
答案
A.铅蓄电池放电时,正极发生的反应是PbO2+4H++SO42-+2e-=PbSO4(s)+2H2O,故A错误;
B.电解苦卤水时,阳极上还原性强的离子先失电子发生氧化反应,a电极首先放电的是Br-而不是Cl-,说明当其它条件相同时Br-的还原性强于Cl-,故B正确;
C.铅蓄电池充电时,A极应与外接电源正极相连,故C错误;
D.忽略能量消耗,b电极上析出氢气,当b极产生0.02g气体时,转移电子的物质的量=
×2=0.02mol,根据Pb+PbO2+4H++2SO42-0.02g 2g/mol
2PbSO4+2H2O知,铅蓄电池中消耗0.02mol H2SO4,故D错误;放电 充电
故选B.
