(1)如图所示装置:①若烧杯中溶液为稀硫酸,则观察到的现象为______.电极反应式为:正极______;负极______.该装置将______能转化为______能.
②若烧杯中溶液为氢氧化钠溶液,则负极为______,总反应方程为______.
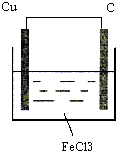
(2)利用Cu+2FeCl3=CuCl2+2FeCl2反应,设计一个原电池,在右面方框中画出装置图(注明正、负极材料及电解液),写出电极反应式.
负极:______,正极:______.
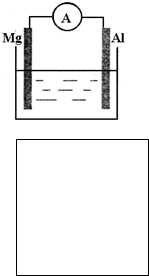
(1)①该装置为原电池装置,将化学能转变为电能,镁比铝活泼,当溶液呈酸性时,镁作原电池负极,发生氧化反应,电极反应为Mg-2e-=Mg2+,铝作正极,发生还原反应,电极反应为2H++2e-=H2↑,
故答案为:镁逐渐溶解铝极上有气泡冒出电流表指针发生偏转;2H++2e-=H2↑;Mg-2e-=Mg2+;化学;电;
②当溶液呈碱性时,铝能与NaOH溶液反应,而镁不反应,所以铝作负极,镁作正极,电池总反应和铝与NaOH溶液的反应相同,为,故答案为:Al;2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(2)在Cu+2FeCl3=CuCl2+2FeCl2反应中,Cu被氧化,应为原电池负极反应,电极反应式为Cu-2e-=Cu2+,FeCl3被还原,应为正极反应,电极反应式为2Fe3++2e-=2Fe2+,则电解质溶液为FeCl3,正极为石墨或活泼性比铜弱的金属,
故答案为:Cu-2e-=Cu2+;2Fe3++2e-=2Fe2+;