一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”.如2Fe3++Cu=2Fe2++Cu2+,可拆写为氧化反应式:Cu→Cu2++2e-,还原反应式:2Fe3++2e-→2Fe2+.并由此实现了化学能与电能的相互转化.据此,回答下列问题:
(1)将反应Zn+2H+═Zn2++H2↑拆写为两个“半反应式”:其中,氧化反应式为:______.
(2)由题(1)反应,设计成原电池如图所示:若电极a为Zn,电极b可选择材料:______(只填一种);电解质溶液甲是______;电极b处的电极反应式:______.
(3)由反应2H2+O2
2H2O,设计出以稀硫酸为电解质溶液的燃料电池,其电极反应式为:负极______,正极______. 点燃 .
(4)以惰性材料为电极,电解100mL pH=6的硫酸铜溶液,当电解池内溶液的pH为1时,电极上析出的铜的质量为______(忽略电解前后溶液体积的变化).
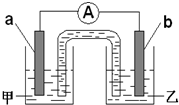
(1)根据方程式知,锌失电子发生氧化反应,所以其反应式为:Zn=Zn2++2e-,
故答案为:Zn=Zn2++2e-;
(2)反应Zn+2H+═Zn2++H2↑,若电极a为Zn,电极b为不如锌活泼的金属或导电的非金属,如铜等,电极和相应的电解质溶液含有相同的阳离子,可以是硫酸锌溶液,正极上氢离子得电子发生还原反应,电极反应式为:2H++2e-=H2↑,
故答案为:Cu,ZnSO4,2H++2e-=H2↑;
(3)由反应2H2+O2
2H2O,设计出以稀硫酸为电解质溶液的燃料电池,负极上失电子发生氧化反应,电极反应式为:2H2-4e-=4H+,正极上氧气得电子发生还原反应,电极反应式为:O2+4H++4e-=2H2O, 点燃 .
故答案为:负极:2H2-4e-=4H+,正极:O2+4H++4e-=2H2O;
(4)设析出铜的质量是x,
电解硫酸铜溶液的方程式为:2Cu 2++2H2O
2Cu↓+O2↑+4H+, 电解 .
128g 4mol
x 0.1mol/L×0.1L
x=
=0.32g,0.1mol/L×0.1L×128g 4mol
答:电极上析出的铜的质量为0.32g.
