问题
填空题
(1)某化学反应,设反应物的总能量为E1,生成物的总能量为E2,若E1>E2,则该反应为______热反应.中和反应都是______热反应,其实质是______.(用离子方程式表示)
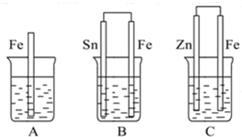
(2)如图:A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.
①A中反应的离子方程式为______.
②B中Sn极是______极,其电极反应式为______,
③C中被腐蚀的金属是______,总反应的化学方程式为______,比较A、B、C中铁被腐蚀的速率,由快到慢的顺序为______(填序号).
答案
(1)设反应物的总能量为E1,生成物的总能量为E2,若E1>E2,则该反应为放热反应,中和反应都是放热反应,反应的实质为H++OH-═H2O,
故答案为:放;放;H++OH-═H2O;
(2)①铁与硫酸反应的离子方程式为:Fe+2H+=Fe2++H2↑,故答案为:Fe+2H+═Fe2++H2↑;
②B中Fe为负极,Sn为正极,正极发生2H++2e-=H2↑,故答案为:正;2H++2e-═H2↑;
③A发生化学腐蚀,B中Fe为负极,Sn为正极,Fe被腐蚀,C中Zn为负极,Fe为正极,Fe被保护,Zn被腐蚀,总方程式为Zn+H2SO4═ZnSO4+H2↑,则A、B、C中铁被腐蚀的速率,由快到慢的顺序是B、A、C,
故答案为:Zn;Zn+H2SO4═ZnSO4+H2↑;B>A>C.
