如图所示甲、乙两电化学装置(一个为原电池,一个为电解池),其电极材料都是铁棒与碳棒,装置部分外电路未画完整,若两装置中均盛放CuSO4溶液,一段时间后甲池中的碳棒和乙池中的铁棒均有红色物质析出.请回答下列问题:
(1)甲是______(填写装置名称,下同);乙是______.
(2)甲乙装置中铁电极的名称分别是______、______.
(3)甲乙装置中碳电极上发生反应的电极反应式分别是.甲:______;乙:______.
(4)若两装置中均盛放饱和NaCl溶液.则甲池中碳电极的电极反应式为______.现乙装置中转移0.02mol电子后停止实验,装置中溶液的体积是200mL,则此时溶液中c(OH-)=______(不考虑产物的相互反应).
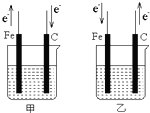
(1)甲装置中电子从铁电极出来,乙装置中电子向铁电极移动,由此说明能自发的进行氧化还原反应是甲,乙不能自发的进行氧化还原反应,所以甲是原电池,乙是电解池,
故答案为:原电池,电解池;
(2)甲池中铁易失电子而作负极,乙池中铁上得电子发生氧化反应,所以铁作阴极,
故答案为:负极,阴极;
(3)甲池中碳棒作正极,正极上铜得电子发生还原反应,电极反应式为:2Cu2++2e-=Cu,乙池中碳棒作阳极,阳极上氢氧根离子放电生成氧气,电极反应式为:4OH--4e-=2H2O+O2↑,
故答案为:甲:2Cu2++2e-=Cu,乙:4OH--4e-=2H2O+O2↑;
(4)①如果甲池中是氯化钠溶液,则铁发生吸氧腐蚀,正极上氧气得电子发生还原反应,电极反应式为:O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
②乙池中电解氯化钠溶液时,阳极上氯离子放电,阴极上氢离子放电,所以电池反应式为:2NaCl+2H2O
Cl2↑+H2↑+2NaOH,当有0.02mol电子转移时,生成氢氧化钠的物质的量是0.02mol,则生成氢氧化钠的物质的量浓度=电解 .
=0.1mol/L,0.02mol 0.2L
故答案为:0.1mol•L-1.
