将纯锌片和纯铜片按如图方式插入100ml相同浓度的稀硫酸中一段时间,请回答下列问题:
(1)下列说法正确的是______.
A、甲、乙均为化学能转变为电能的装置
B、乙中铜片上没有明显变化
C、甲中铜片质量减少、乙中锌片质量减少
D、两烧杯中溶液的pH均增大
(2)在相同时间内,两烧杯中产生气泡的速度:甲______乙(填“>”、“<“或“=”).
(3)当甲中产生1.12L(标准状况)气体时,通过导线的电子为______mol.
(4)这时,甲中负极发生氧化反应,溶解了______g.
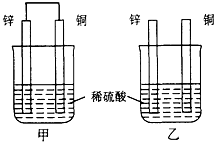
(1)A、甲符合原电池构成条件,所以属于原电池,乙不能构成闭合回路,所以不能构成原电池,故A错误;
B、乙不能构成原电池,氢离子在锌片上得电子发生还原反应,所以乙中铜片上没有明显变化,故B正确;
C、甲中铜片作正极,正极上氢离子得电子生成氢气,所以铜片质量不变,乙中锌片和氢离子发生置换反应,所以质量减少,故C错误;
D、两烧杯中锌和氢离子发生置换反应导致溶液中氢离子浓度减小,所以溶液的pH均增大,故D正确;
故选:BD;
(2)甲能构成原电池,乙不能构成原电池,作原电池负极的金属加速被腐蚀,所以在相同时间内,两烧杯中产生气泡的速度:甲>乙,故答案为:>;
(3)甲中,铜电极上氢离子得电子生成氢气,电极反应式为2H++2e-=H2↑,根据电极反应式知,通过电子的物质的量=
×2=0.1mol,1.12L 22.4L/mol
故答案为:0.1;
(4)甲中负极锌上电极反应式为Zn-2e-=Zn2+,正极电极反应式为2H++2e-=H2↑,根据锌和氢气之间的关系式知,溶解锌的质量=
×65g/mol=3.25g,
×21.12L 22.4L/mol 2
故答案为:3.25.
