如图所示2套实验装置,分别回答下列问题.
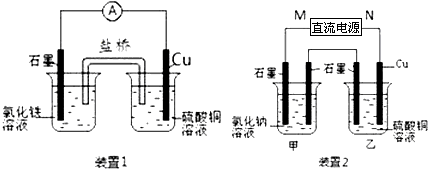
(1)装置1中的Cu是______极(填“正”或“负”),该装置发生的总反应的离子方程式为______.
(2)装置2中甲烧杯盛放100mL0.2mol/L的NaCl溶液,乙烧杯盛放100mL0.5mol/L的CuSO4溶液.反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞,观察到右边石墨电极附近首先变红,左边石墨电极附近无明显现象.
①电源的M端为______极,甲烧杯右边石墨电极附近首先变红的原因是______.
②乙烧杯中电解反应的离子方程式为______.
③若装置甲阴、阳两极各产生112mL气体(标准状况),则装置乙所得溶液的pH为______(忽略反应前后溶液的体积变化).
(1)装置1为原电池,铜为负极,被氧化,石墨正极,电池反应为2Fe3++Cu═2Fe2++Cu2+,故答案为:负;2Fe3++Cu═2Fe2++Cu2+;
(2)向甲烧杯中滴入几滴酚酞,观察到右边石墨电极附近首先变红,说明甲中右边电极生成OH-,应为电解池的阴极,则M为电源的正极,N为电源的负极,甲为电解食盐水装置,乙为电解硫酸铜装置,则
①由以上分析可知M为正极,阴极上分别发生H2O⇌H++OH-、2H++2e-═H2↑,c(OH-)>c(H+),溶液呈碱性,
故答案为:正;H2O⇌H++OH-,H++2e-═H2↑,c(OH-)>c(H+),溶液呈碱性;
②乙为电解硫酸铜溶液,阳极生成氧气,阴极生成铜,电解的方程式为2Cu2++2H2O
2Cu+O2↑+4H+,故答案为:2Cu2++2H2O电解 .
2Cu+O2↑+4H+;电解 .
③若装置甲阴、阳两极各产生112mL气体(标准状况),则n(H2)=
=0.005mol,由2H++2e-═H2↑可知转移0.01mol电子,由2Cu2++2H2O0.112L 22.4L/mol
2Cu+O2↑+4H+可知,生成0.01molH+,则c(H+)=电解 .
=0.1mol/L,pH=1,0.01mol 0.1L
故答案为:1.
