问题
填空题
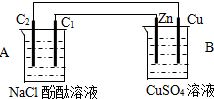
按如图装置进行实验,并回答下列问题:
(1)判断装置的名称:A池为______.
(2)锌电极反应式为______,石墨棒C1为______极,电极反应式为______,石墨棒C2附近发生的实验现象为______.
(3)当C2极析出2.24L气体(标准状态)时,锌的质量减少了______g.CuSO4溶液的质量增加了______g.
答案
(1)右侧装置为铜锌原电池,则左侧装置为电解池,电解食盐水,故答案为:电解池;
(2)Zn比Cu活泼,为原电池的负极,发生氧化反应,电极方程式为Zn-2e-=Zn2+,C1为阴极,发生还原反应,电极方程式为2H++2e-=H2↑,C2极为阳极,发生氧化反应,生成氯气,可观察到产生黄绿色气体,
故答案为:Zn-2e-=Zn2+;阴;2H++2e-=H2↑;产生黄绿色气体;
(3)当C2极析出2.24L气体(标准状态)时,n(Cl2)=0.01mol,则转移0.2mol电子,由Zn-2e-=Zn2+可知,消耗0.1molZn,质量为6.5g,正极上析出0.1molCu,其质量为6.4g,则溶液的质量增加0.1g,
故答案为:6.5;0.1.
